1 de junio de 2020
Entrenamiento de fuerza y ciencia
Inactividad Física y Covid-19: Riesgos Ignorados – Parte 2
Ahora que has tenido tiempo para asimilar la introducción de Inactividad Física y Covid-19 (¿creías que habíamos acabado?) podemos profundizar y volver a lo que te trajo aquí en primer lugar!
Inactividad Física y Masa Muscular
La preservación de la masa muscular requiere un suministro constante de estímulos mecánicos que estimulan directa o indirectamente la síntesis de proteínas80. Cuando dejamos de entrenar, estos estímulos esenciales requeridos para el anabolismo muscular se eliminan y el equilibrio entre la síntesis y la degradación de proteínas se rompe hacia la degradación. En pocos días, se pueden encontrar signos objetivos de atrofia muscular. De hecho, pérdidas significativas del cuádriceps se han reportado después de tan solo 2 días de inmovilización de la pierna (1.7%) 81 o 5 días de reposo en cama (2%) 82, lo cual esta asociado a una pérdida aún mayor de fuerza muscular (8–9%) 82–84. Durante los siguientes días y semanas, la atrofia muscular es capaz de progresar a un ritmo inexorable, 6% aprox. después de 10 días 78, 10% después de 29 días 85, 13% después de 60 días 82, alcanzando el 18% después de 90 días 86. Esta tasa de atrofia muscular crece exponencialmente, prediciendo una pérdida de masa muscular de ∼10% en 30 días y de ∼15% en 60 días.
 Figura 8 Complicaciones de la pérdida de masa corporal magra (músculo)87.
Figura 8 Complicaciones de la pérdida de masa corporal magra (músculo)87.
Una encuesta reciente realizada sobre el impacto del sedentarismo en 6733 personas de 18 a 98 años mostró una asociación clara entre la actividad física, la masa magra (músculo) y la grasa corporal 88. Esencialmente, el estudio demostró que la actividad física es exitosa para mantener la masa libre de grasa, evitar el exceso de grasa corporal y bajar la tasa de obesidad. Además, al comparar la masa y la función muscular de las personas sedentarias de 20 a 80 años con las de sus equivalentes de una población de atletas, queda claro que mantener un alto nivel de actividad física preserva la masa muscular y la función durante toda la vida89.
Este beneficio se traduce en una ganancia de aproximadamente 20 a 25 años en términos de edad biológica cuando se compara la masa muscular y el rendimiento de atletas de 3 edad vs sedentarios 89,90. Del mismo modo, las personas entrenadas durante el transcurso de su vida muestran un 30% más de fuerza muscular en comparación con las personas sedentarias de la misma edad 91. Sorprendentemente, los beneficios de llevar un estilo de vida activo protegen no sólo contra la pérdida de masa muscular y fuerza, sino que también parecen proteger contra la denervación muscular progresiva que acompaña al proceso de envejecimiento y se ve exacerbada por la inactividad 92.
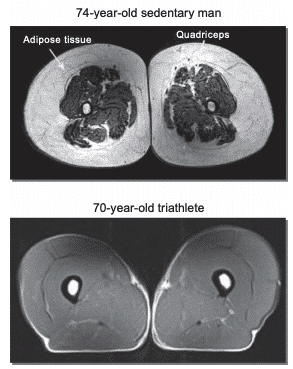 Figura 9 Resonancia magnética nuclear mostrando diferencias en el tejido adiposo subcutáneo entre un hombre de 74 años sedentario vs un triatleta de 70 años93
Figura 9 Resonancia magnética nuclear mostrando diferencias en el tejido adiposo subcutáneo entre un hombre de 74 años sedentario vs un triatleta de 70 años93
La pérdida muscular asociada con el envejecimiento, el desuso y ciertas condiciones patológicas, puede conducir a una salud adversa y deterioros en la calidad de vida. La pérdida de masa muscular, fuerza y función muscular tiene consecuencias adversas no solo locales sino también sistémicas que conllevan a una discapacidad física, funcional y congitiva87.
Inactividad Física y Control Metabólico
La situación actual reducirá la actividad física a niveles muy por debajo de la recomendación diaria de 7500–10,000 pasos por día exacerbando los problemas de salud derivados de la inactividad física 55,94. Es importante destacar que los efectos negativos para la salud pueden verse relativamente rápido (3–14 días) cuando se acentúa la disminución de la actividad, como sucederá en todo el mundo en la pandemia actual95.
Adicionalmente, parecería ser que 2 semanas de actividad física reducida (de> 3500 a <1500 pasos / día) en personas mayores sanas (> 65 años y normalmente la proporción más inactiva de la población) generan un aumento pequeño pero medible en la resistencia a la insulina y una reducción en la tasa postprandial de síntesis de proteínas musculares96.
Actividades sedentarias como el trabajo de oficina, ver televisión y sentarse están asociadas no solo con el aumento de la mortalidad previamente mencionado, sino también con un aumento de la morbilidad (síndrome metabólico, enfermedad cardiovascular) 97–99. La asociación se resume en una revisión reciente que concluyó: «Los niveles más altos de actividad física total, a cualquier intensidad, y el menor tiempo de permanencia sedentaria se asocian con un riesgo sustancialmente reducido de mortalidad prematura, con evidencia de un patrón no lineal de dosis-respuesta en adultos de mediana edad y mayores 100”.
Los mecanismos por los cuales la inactividad genera una disminución en la sensibilidad a la insulina sistémica y una intolerancia a la glucosa están íntimamente relacionados a modificaciones dentro del músculo esquelético 101–104.
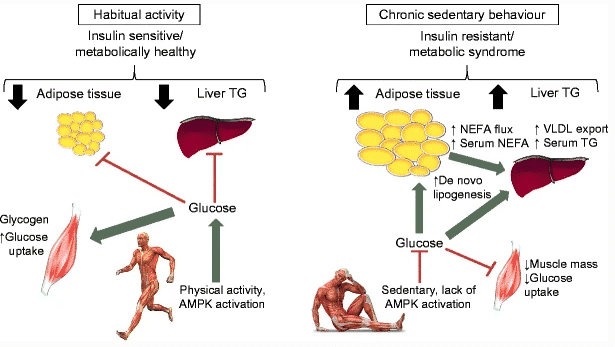 Figura 10 Ser habitualmente activo promueve la activación de vías metabólicas relacionadas a la absorción de glucosa en el músculo esquelético; Por lo tanto, se preserva la sensibilidad a la insulina y se desvía menos glucosa a depósitos metabólicamente desfavorables 105.
Figura 10 Ser habitualmente activo promueve la activación de vías metabólicas relacionadas a la absorción de glucosa en el músculo esquelético; Por lo tanto, se preserva la sensibilidad a la insulina y se desvía menos glucosa a depósitos metabólicamente desfavorables 105.
La evidencia sugiere que 7-10 días de reposo en cama en individuos sanos conduce a un 10–34% de disminución de la sensibilidad a la insulina en todo el cuerpo 102,106. Sin embargo, la disminución de la sensibilidad a la insulina medida mediante el equilibrio arteriovenoso en el antebrazo 102 o la pierna 107 muestra resultados mucho mayores (47. –75%). Esta diferencia se debe a que el antebrazo y la pierna muestran en mayo detalle el metabolismo del músculo esquelético, enfatizando el papel fundamental del mismo en la resistencia a la insulina inducida por la inactividad, que parece ser atribuible a la reducción de la contracción muscular per se108.
La disminución de la sensibilidad a la insulina con la inactividad física no está directamente relacionada con los cambios en la composición corporal (pérdida de masa muscular, aumento del porcentaje de grasa corporal) ya que la misma se desarrolla rápidamente (en unos pocos días) y mucho antes de que se establezca una atrofia muscular y/o aumento de la grasa corporal (o deposición de grasa ectópica) 109. Paralelamente, y posiblemente relacionado con la resistencia a la insulina inducida por la inactividad, está la elevada carga inflamatoria que puede ocurrir con el reposo prolongado 108.
En tiempos de restricciones debido a la pandemia de COVID19, es importante darse cuenta de lo imprescindible que es una cantidad moderada de ejercicio diario de intensidad suficiente 110. Cualquier adición a este régimen mínimo conducirá a mejoras en todos los marcadores de salud.
Inactividad Física e Impacto Cardiorrespiratorio
El VO2max es la máxima capacidad de tomar oxigeno del ambiente en los pulmones, trasportarlo en la sangre y utilizarlo por el organismo, principalmente en los músculos y, por lo tanto, el mismo se considera una variable que evalúa el rendimiento máximo del sistema cardiorrespiratorio y los músculos esqueléticos en el transporte y en la utilización de O2111. Además de ser uno de los principales determinantes de la tolerancia al ejercicio, el VO2max se considera un índice de «aptitud cardiorrespiratoria». Tanto en sujetos sanos como en pacientes con enfermedades cardiovasculares «la capacidad de ejercicio es uno de los predictores más fuertes de mortalidad incluso mas que otros factores de riesgo establecidos para enfermedades cardiovasculares»112. Según los mismos autores, por cada 1 MET incrementado, la mortalidad por aptitud cardiorrespiratoria disminuye en un 12% 112.
Saltin y cols., uno de los padres de la fisiología del ejercicio, en el año 1968, mostró que los individuos pierden en promedio el 28% del consumo máximo de oxígeno (VO2max) y el 11% del volumen cardíaco luego de un período de 20 días en cama113.
En sintonía con estos datos, un estudio reciente “anticipó” de manera muy similar el contexto al que cientos de millones de personas, en todo el mundo, ahora están expuestas como consecuencia del confinamiento en el hogar. En ese estudio, un grupo de hombres jóvenes y sanos redujo de forma aguda la cantidad de pasos por día, desde una línea de base de ∼10,000 a ∼1350, y mantuvo este nivel de actividad durante 2 semanas114. ¿El Efecto?, devastador, luego de las 2 semanas, los sujetos presentaron una disminución de ~ 7% en el VO2max114. Curiosamente, la tasa de disminución del VO2max reportada, fue notablemente similar a la tasa promedio de disminución del VO2max observada en los estudios de reposo en cama 115. Esta tasa de disminución parece ser lineal ante la duración de la inactividad.
Si asumimos que la tasa de disminución del VO2max es lineal también después de una inactividad forzada no asociada con el reposo en cama (como el confinamiento por el COVID-19), durante un período de 2 meses, el VO2max disminuiría aproximadamente un 30%!!!, un numero poco real y especulativo pero suficiente como para intentar evitar que el peor escenario posible se transforme en realidad.
En cuanto a los sujetos de tercera edad, la disminución porcentual en el VO2máx durante un reposo en cama de 2 semanas fue dos veces mayor (−15%) frente a la observada en jóvenes116. Aún mas, durante un período de vuelta a la actividad de 2 semanas post reposo en cama, los sujetos jóvenes parecerían recuperar el valor basal de VO2 máx, mientras que los ancianos la recuperación es menor o incluso e incompleta 116 complicando aún mas el panorama para dicha población.
Por lo tanto, en un sujeto hipotético sedentario de 70 años con un VO2max de ∼25 ml/kg/min-1, una inactividad forzada de 4 semanas probablemente se traduciría en una disminución de ∼15% en el VO2max, correspondiente a una disminución de ∼3.75 ml/kg/min-1, lo que equivale a ∼1 MET: Lo que, a su vez, se traduciría en un aumento de ∼12% en la mortalidad.
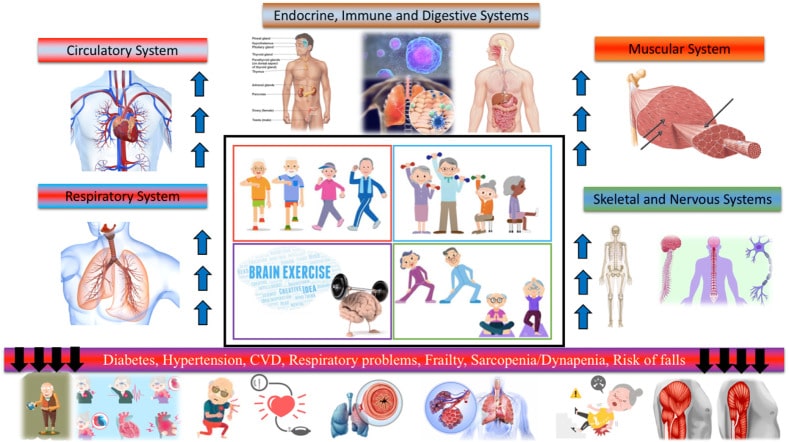 Figura 11 El ejercicio físico mejora la salud de las personas mayores al actuar sobre los diferentes sistemas y órganos117.
Figura 11 El ejercicio físico mejora la salud de las personas mayores al actuar sobre los diferentes sistemas y órganos117.
Por último, parecería existir una relación dosis-respuesta directa entre el «volumen» del ejercicio (duración x intensidad) y la aptitud cardiorrespiratoria. Aproximadamente el 50% de los efectos protectores de la actividad física se explican por una reducción de los factores de riesgo cardiovascular tradicionales, como la presión arterial alta y los lípidos en la sangre55. Otros efectos protectores presumiblemente se relacionan con una disminución de la inflamación de bajo grado del tejido adiposo visceral y con una disminución de la resistencia a la insulina55.
Conclusiones
La evidencia sobre la importancia del ejercicio físico para preservar la salud y la calidad de vida es incontrovertible como también es ineludible el impacto perjudicial de la pandemia de COVID-19 sobre el sedentarismo e inactividad 117,118. Es importante tener en cuenta que también podemos estar en riesgo de un ciclo vicioso donde los patrones de inactividad actuales y potencialmente acelerados pueden magnificar el impacto de la actual y futuras pandemias. No es sorprendente que las personas infectadas con COVID-19 tienen muchas más chances de ser hospitalizados y tener peor pronóstico si padecen afecciones médicas subyacentes, tales como enfermedades crónicas, que afectan la respuesta inmune. Además, la evidencia muestra un riesgo significativamente mayor de enfermedades crónicas en personas físicamente6,8,117,118.
Ergo, la relación entre la inactividad física y los riesgos de complicaciones de salud y tasas de mortalidad asociadas con COVID-19 no se puede seguir ignorando. Si la prevalencia de afecciones crónicas provocadas por estilos de vida poco saludables fuera menor, ¿se reducirían los efectos catastróficos de la pandemia de COVID-19?.
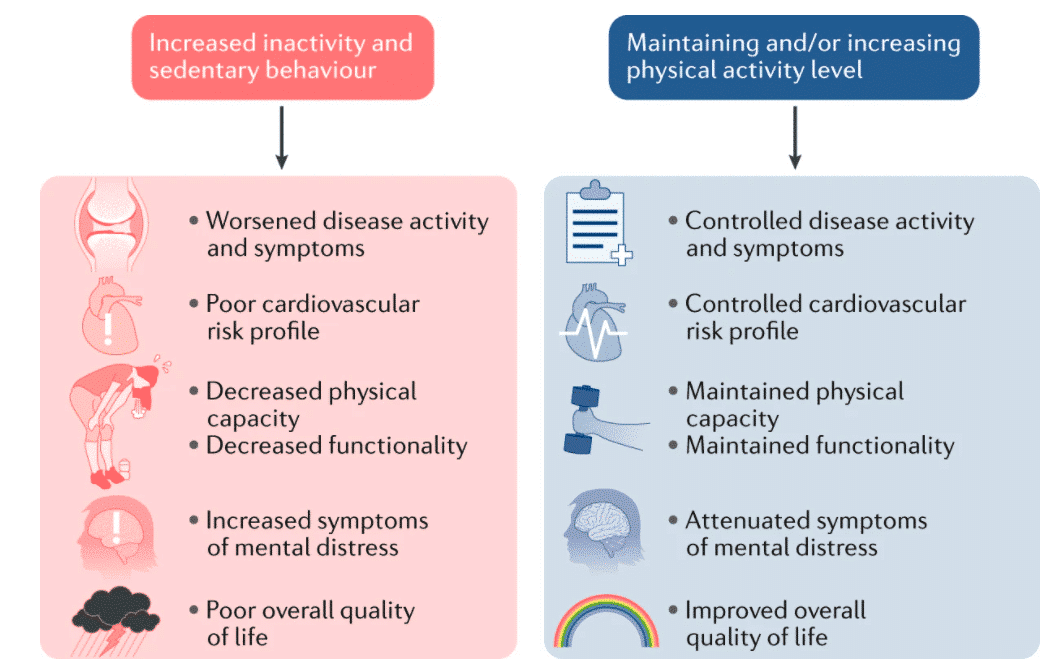 Figura 12 La inactividad física y el comportamiento sedentario pueden ser perjudiciales para la salud, el perfil de riesgo cardiovascular, la capacidad física y la función y la salud mental, lo que resulta en una mala calidad de vida, mientras que mantener niveles de actividad física más óptimos puede ayudar a mejorar estos efectos perjudiciales119.
Figura 12 La inactividad física y el comportamiento sedentario pueden ser perjudiciales para la salud, el perfil de riesgo cardiovascular, la capacidad física y la función y la salud mental, lo que resulta en una mala calidad de vida, mientras que mantener niveles de actividad física más óptimos puede ayudar a mejorar estos efectos perjudiciales119.
Por todo esto, durante la cuarentena, mantenerse físicamente activo es esencial para la salud mental y física. Afortunadamente, una amplia gama de ejercicios, como ejercicios aeróbicos o entrenamiento de fuerza con o sin equipamiento, aprovechando nuevas tecnologías que permiten ser guiado por profesionales idóneos mediante video o aplicación, se pueden realizar en el hogar y deben fomentarse. En esta línea, los gobiernos nacionales, federales y regionales de todo el mundo deberían contemplar el rol de los centros de entrenamiento, gimnasios y clubes en no solo la prevención de problemas de salud incluidos COVID-19 sino también en el potencial efecto paliativo que puede tener una población activa en el colapso de los sistemas de salud. Estos también deberían permitir la realización de actividades físicas al aire libre (por ejemplo, caminar, correr u otros deportes individuales), y así evitar que la pandemia COVID-19 genere consecuencias desfavorables mas allá del virus 120.
Referencias
1.Zhu, N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. New England Journal of Medicine 382, 727–733 (2020).
2.Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nature microbiology 5, 536–544 (2020).
3.Parnell, D., Widdop, P., Bond, A. & Wilson, R. COVID-19, networks and sport. Managing Sport and Leisure 1–7 (2020). doi:10.1080/23750472.2020.1750100
4.Hammami, A., Harrabi, B., Mohr, M. & Krustrup, P. Physical activity and coronavirus disease 2019 (COVID-19): specific recommendations for home-based physical training. Managing Sport and Leisure 1–6 (2020). doi:10.1080/23750472.2020.1757494
5.Chen, P. et al. Coronavirus disease (COVID-19): The need to maintain regular physical activity while taking precautions. Journal of Sport and Health Science 9, 103–104 (2020).
6.Stevens, A. M. H. Lessons from covid-19: visiting patients at home and assessing comorbidities. BMJ m1385 (2020). doi:10.1136/bmj.m1385
7.Dayal, D. We urgently need guidelines for managing COVID‐19 in children with comorbidities. Acta Paediatrica (2020). doi:10.1111/apa.15304
8.Ebrahimi, M., Saki Malehi, A. & Rahim, F. COVID-19 Infection in Medical Staffs versus Patients: A Systematic Review and Meta-analysis of Laboratory Findings, Comorbidities, and Clinical Outcome. SSRN Electronic Journal (2020). doi:10.2139/ssrn.3580517
9.Hall, G., Laddu, D. R., Phillips, S. A., Lavie, C. J. & Arena, R. A tale of two pandemics: How will COVID-19 and global trends in physical inactivity and sedentary behavior affect one another? Progress in Cardiovascular Diseases (2020). doi:10.1016/j.pcad.2020.04.005
10.Knipe, D. M. et al. Fundamental Virology, 4th Edition; and Fields Virology, 4th Edition, Volumes I and II:Fundamental Virology, 4th Edition;Fields Virology, 4th Edition, Volumes I and II. Clinical Infectious Diseases 34, 1029–1030 (2002).
11.Falsey, A. R. & Walsh, E. E. Novel coronavirus and severe acute respiratory syndrome. The Lancet 361, 1312–1313 (2003).
12.Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273 (2020).
13.Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet 395, 507–513 (2020).
14.Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet 395, 497–506 (2020).
15.Yang, J. et al. Prevalence of comorbidities and its effects in patients infected with SARS-CoV-2: a systematic review and meta-analysis. International Journal of Infectious Diseases 94, 91–95 (2020).
16.Wu, Z. & McGoogan, J. M. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. JAMA 323, 1239 (2020).
17.De Groot, R. J. et al. Middle East respiratory syndrome coronavirus (MERS-CoV): announcement of the Coronavirus Study Group. Journal of virology 87, 7790–2 (2013).
18.Zaki, A. M., van Boheemen, S., Bestebroer, T. M., Osterhaus, A. D. M. E. & Fouchier, R. A. M. Isolation of a Novel Coronavirus from a Man with Pneumonia in Saudi Arabia. New England Journal of Medicine 367, 1814–1820 (2012).
19.An, P., Song, P., Wang, Y. & Liu, B. Asymptomatic Patients with Novel Coronavirus Disease (COVID-19). Balkan Medical Journal (2020). doi:10.4274/balkanmedj.galenos.2020.2020.4.20
20.Dahl, E. Coronavirus (Covid-19) outbreak on the cruise ship Diamond Princess. International Maritime Health 71, 5–8 (2020).
21.Zhang, S. et al. Estimation of the reproductive number of novel coronavirus (COVID-19) and the probable outbreak size on the Diamond Princess cruise ship: A data-driven analysis. International Journal of Infectious Diseases 93, 201–204 (2020).
22.Russell, T. W. et al. Estimating the infection and case fatality ratio for coronavirus disease (COVID-19) using age-adjusted data from the outbreak on the Diamond Princess cruise ship, February 2020. Eurosurveillance 25, (2020).
23.Salje, H. et al. Estimating the burden of SARS-CoV-2 in France. Science (New York, N.Y.) eabc3517 (2020). doi:10.1126/science.abc3517
24.Onder, G., Rezza, G. & Brusaferro, S. Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy. JAMA (2020). doi:10.1001/jama.2020.4683
25.Rezende, L. F. M. de, Rey-López, J. P., Matsudo, V. K. R. & Luiz, O. do C. Sedentary behavior and health outcomes among older adults: a systematic review. BMC Public Health 14, (2014).
26.Banerjee, A. et al. Estimating excess 1-year mortality associated with the COVID-19 pandemic according to underlying conditions and age: a population-based cohort study. The Lancet (2020). doi:10.1016/s0140-6736(20)30854-0
27.Fehr, A. R. & Perlman, S. Coronaviruses: an overview of their replication and pathogenesis. Methods in molecular biology (Clifton, N.J.) 1282, 1–23 (2015).
28.Weiss, S. R. & Navas-Martin, S. Coronavirus Pathogenesis and the Emerging Pathogen Severe Acute Respiratory Syndrome Coronavirus. Microbiology and Molecular Biology Reviews 69, 635–664 (2005).
29.Perlman, S. Research Driven by Curiosity: The Journey from Basic Molecular Biology and Virology to Studies of Human Pathogenic Coronaviruses. PLOS Pathogens 11, e1005023 (2015).
30.Song, Z. et al. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses 11, 59 (2019).
31.Andersen, K. G., Rambaut, A., Lipkin, W. I., Holmes, E. C. & Garry, R. F. The proximal origin of SARS-CoV-2. Nature medicine 26, 450–452 (2020).
32.Cui, J., Li, F. & Shi, Z.-L. Origin and evolution of pathogenic coronaviruses. Nature Reviews Microbiology 17, 181–192 (2018).
33.Decaro, N. & Lorusso, A. Novel human coronavirus (SARS-CoV-2): A lesson from animal coronaviruses. Veterinary Microbiology 244, 108693 (2020).
34.Majumder, M. & Mandl, K. D. Early Transmissibility Assessment of a Novel Coronavirus in Wuhan, China. SSRN Electronic Journal (2020). doi:10.2139/ssrn.3524675
35.Lauer, S. A. et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Annals of Internal Medicine 172, 577–582 (2020).
36.Wang, D. et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA 323, 1061 (2020).
37.Zhang, H. et al. Clinical characteristics of 194 cases of COVID-19 in Huanggang and Taian, China. Infection (2020). doi:10.1007/s15010-020-01440-5
38.Wang, W., Tang, J. & Wei, F. Updated understanding of the outbreak of 2019 novel coronavirus (2019‐nCoV) in Wuhan, China. Journal of Medical Virology 92, 441–447 (2020).
39.Li, W. et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 426, 450–454 (2003).
40.Jia, H. P. et al. ACE2 Receptor Expression and Severe Acute Respiratory Syndrome Coronavirus Infection Depend on Differentiation of Human Airway Epithelia. Journal of Virology 79, 14614–14621 (2005).
41.Walls, A. C. et al. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell 181, 281–292.e6 (2020).
42.Letko, M., Marzi, A. & Munster, V. Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses. Nature Microbiology 5, 562–569 (2020).
43.Tay, M. Z., Poh, C. M., Rénia, L., MacAry, P. A. & Ng, L. F. P. The trinity of COVID-19: immunity, inflammation and intervention. Nature Reviews Immunology (2020). doi:10.1038/s41577-020-0311-8
44.Qin, C. et al. Dysregulation of Immune Response in Patients With Coronavirus 2019 (COVID-19) in Wuhan, China. Clinical Infectious Diseases (2020). doi:10.1093/cid/ciaa248
45.Zhou, Y. et al. Pathogenic T cells and inflammatory monocytes incite inflammatory storm in severe COVID-19 patients. National Science Review (2020). doi:10.1093/nsr/nwaa041
46.Tian, S. et al. Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer. Journal of Thoracic Oncology 15, 700–704 (2020).
47.Small, B. A. et al. CD8+ T Cell–mediated Injury In Vivo Progresses in the Absence of Effector T Cells. Journal of Experimental Medicine 194, 1835–1846 (2001).
48.Liu, S. et al. Neutrophil extracellular traps are indirectly triggered by lipopolysaccharide and contribute to acute lung injury. Scientific Reports 6, (2016).
49.Matthews, C. E. et al. Amount Of Time Spent In Sedentary Behaviors And Cause-specific Mortality In Us Adults. Medicine & Science in Sports & Exercise 43, 28 (2011).
50.Wilmot, E. G. et al. Sedentary time in adults and the association with diabetes, cardiovascular disease and death: systematic review and meta-analysis. Diabetologia 55, 2895–2905 (2012).
51.KATZMARZYK, P. T., CHURCH, T. S., CRAIG, C. L. & BOUCHARD, C. Sitting Time and Mortality from All Causes, Cardiovascular Disease, and Cancer. Medicine & Science in Sports & Exercise 41, 998–1005 (2009).
52.Stamatakis, E., Hamer, M. & Dunstan, D. W. Screen-Based Entertainment Time, All-Cause Mortality, and Cardiovascular Events. Journal of the American College of Cardiology 57, 292–299 (2011).
53.Hu, F. B. Television Watching and Other Sedentary Behaviors in Relation to Risk of Obesity and Type 2 Diabetes Mellitus in Women. JAMA 289, 1785 (2003).
54.FORD, E. S. et al. Television watching and incident diabetes: Findings from the European Prospective Investigation into Cancer and Nutrition-Potsdam Study. Journal of Diabetes 2, 23–27 (2010).
55.Booth, F. W., Roberts, C. K., Thyfault, J. P., Ruegsegger, G. N. & Toedebusch, R. G. Role of Inactivity in Chronic Diseases: Evolutionary Insight and Pathophysiological Mechanisms. Physiological Reviews 97, 1351–1402 (2017).
56.Lee, I.-M. et al. Effect of physical inactivity on major non-communicable diseases worldwide: an analysis of burden of disease and life expectancy. The Lancet 380, 219–229 (2012).
57.Booth, F. W., Roberts, C. K. & Laye, M. J. Lack of Exercise Is a Major Cause of Chronic Diseases. Comprehensive Physiology (2012). doi:10.1002/cphy.c110025
58.Ruiz-Casado, A. et al. Exercise and the Hallmarks of Cancer. Trends in Cancer 3, 423–441 (2017).
59.LI, R. et al. Associations of Muscle Mass and Strength with All-Cause Mortality among US Older Adults. Medicine & Science in Sports & Exercise 50, 458–467 (2018).
60.Lang, P. O., Mitchell, W. A., Lapenna, A., Pitts, D. & Aspinall, R. Immunological pathogenesis of main age-related diseases and frailty: Role of immunosenescence. European Geriatric Medicine 1, 112–121 (2010).
61.Gleeson, M. et al. The anti-inflammatory effects of exercise: mechanisms and implications for the prevention and treatment of disease. Nature Reviews Immunology 11, 607–615 (2011).
62.AGRAWAL, A., AGRAWAL, S. & GUPTA, S. Dendritic cells in human aging. Experimental Gerontology 42, 421–426 (2007).
63.Montecino-Rodriguez, E., Berent-Maoz, B. & Dorshkind, K. Causes, consequences, and reversal of immune system aging. Journal of Clinical Investigation 123, 958–965 (2013).
64.Ikeno, Y., Orihuela, C. & Van Remmen, H. Inflammation in Aging and Age-related Disease. Pathobiology of Aging & Age-related Diseases 1, 14729 (2011).
65.Lee, W. et al. Long-term Moderate Exercise Improves T-cell Proliferation In Older Adults. Medicine & Science in Sports & Exercise 36, S228 (2004).
66.Lowder, T., Padgett, D. A. & Woods, J. A. Moderate exercise protects mice from death due to influenza virus. Brain, Behavior, and Immunity 19, 377–380 (2005).
67.Sun, Y. & Woods, J. A. Effects of Acute Eccentric Exercise on Immune Responses to Vaccination in Young and Aged Mice. Medicine & Science in Sports & Exercise 50, 394 (2018).
68.Shephard, R. J. Cardiovascular Exercise Training Extends Influenza Vaccine Seroprotection in Sedentary Older Adults: The Immune Function Intervention Trial. Yearbook of Sports Medicine 2010, 260–262 (2010).
69.Pascoe, A. R., Fiatarone Singh, M. A. & Edwards, K. M. The effects of exercise on vaccination responses: A review of chronic and acute exercise interventions in humans. Brain, Behavior, and Immunity 39, 33–41 (2014).
70.Kohut, M. L. et al. Corrigendum to ‘Moderate exercise improves antibody response to influenza immunization in older adults’ [Vaccine 22 (2004) 2298–2306]. Vaccine 23, 278 (2004).
71.Pedersen, B. K. & Febbraio, M. A. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6. Physiological Reviews 88, 1379–1406 (2008).
72.Muñoz-Cánoves, P., Scheele, C., Pedersen, B. K. & Serrano, A. L. Interleukin-6 myokine signaling in skeletal muscle: a double-edged sword? FEBS Journal 280, 4131–4148 (2013).
73.Welc, S. S. & Clanton, T. L. The regulation of interleukin-6 implicates skeletal muscle as an integrative stress sensor and endocrine organ. Experimental Physiology 98, 359–371 (2012).
74.Wallace, D. L. et al. Prolonged exposure of naïve CD8+T cells to interleukin-7 or interleukin-15 stimulates proliferation without differentiation or loss of telomere length. Immunology 119, 243–253 (2006).
75.Zbinden‐Foncea, H., Francaux, M., Deldicque, L. & Hawley, J. A. Does high cardiorespiratory fitness confer some protection against pro‐inflammatory responses after infection by SARS‐CoV‐2? Obesity (2020). doi:10.1002/oby.22849
76.Cuthbertson, D. P. The influence of prolonged muscular rest on metabolism. Biochemical Journal 23, 1328–1345 (1929).
77.Narici, M. et al. Impact of sedentarism due to the COVID-19 home confinement on neuromuscular, cardiovascular and metabolic health: Physiological and pathophysiological implications and recommendations for physical and nutritional countermeasures. European Journal of Sport Science 1–22 (2020). doi:10.1080/17461391.2020.1761076
78.Narici, M. V. et al. Early Biomarkers of Muscle Atrophy and of Neuromuscular Alterations During 10‐Day Bed Rest. The FASEB Journal 34, 1–1 (2020).
79.Wilkinson, D. J., Piasecki, M. & Atherton, P. J. The age-related loss of skeletal muscle mass and function: Measurement and physiology of muscle fibre atrophy and muscle fibre loss in humans. Ageing Research Reviews 47, 123–132 (2018).
80.Schoenfeld, B. J. The Mechanisms of Muscle Hypertrophy and Their Application to Resistance Training. Journal of Strength and Conditioning Research 24, 2857–2872 (2010).
81.KILROE, S. P., FULFORD, J., JACKMAN, S. R., VAN LOON, L. J. C. & WALL, B. T. Temporal Muscle-specific Disuse Atrophy during One Week of Leg Immobilization. Medicine & Science in Sports & Exercise 52, 944–954 (2020).
82.Mulder, E. et al. Musculoskeletal effects of 5 days of bed rest with and without locomotion replacement training. European Journal of Applied Physiology 115, 727–738 (2014).
83.Demangel, R. et al. Early structural and functional signature of 3-day human skeletal muscle disuse using the dry immersion model. The Journal of Physiology 595, 4301–4315 (2017).
84.De Boer, M. D., Maganaris, C. N., Seynnes, O. R., Rennie, M. J. & Narici, M. V. Time course of muscular, neural and tendinous adaptations to 23 day unilateral lower-limb suspension in young men. The Journal of Physiology 583, 1079–1091 (2007).
85.Alkner, B. A. & Tesch, P. A. Efficacy of a gravity-independent resistance exercise device as a countermeasure to muscle atrophy during 29-day bed rest. Acta Physiologica Scandinavica 181, 345–357 (2004).
86.Alkner, B. A. & Tesch, P. A. Knee extensor and plantar flexor muscle size and function following 90 days of bed rest with or without resistance exercise. European Journal of Applied Physiology 93, 294–305 (2004).
87.Argilés, J. M., Campos, N., Lopez-Pedrosa, J. M., Rueda, R. & Rodriguez-Mañas, L. Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease. Journal of the American Medical Directors Association 17, 789–796 (2016).
88.Kyle, U. G., Morabia, A., Schutz, Y. & Pichard, C. Sedentarism affects body fat mass index and fat-free mass index in adults aged 18 to 98 years. Nutrition 20, 255–260 (2004).
89.Grassi, B., Cerretelli, P., Narici, M. V. & Marconi, C. Peak anaerobic power in master athletes. European Journal of Applied Physiology and Occupational Physiology 62, 394–399 (1991).
90.PEARSON, S. J. et al. Muscle function in elite master weightlifters. Medicine & Science in Sports & Exercise 34, 1199–1206 (2002).
91.AAGAARD, P., MAGNUSSON, P. S., LARSSON, B., KJÆR, M. & KRUSTRUP, P. Mechanical Muscle Function, Morphology, and Fiber Type in Lifelong Trained Elderly. Medicine & Science in Sports & Exercise 39, 1989–1996 (2007).
92.Mosole, S. et al. Long-Term High-Level Exercise Promotes Muscle Reinnervation With Age. Journal of Neuropathology & Experimental Neurology 73, 284–294 (2014).
93.Wroblewski, A. P., Amati, F., Smiley, M. A., Goodpaster, B. & Wright, V. Chronic Exercise Preserves Lean Muscle Mass in Masters Athletes. The Physician and Sportsmedicine 39, 172–178 (2011).
94.Trost, S. G., Blair, S. N. & Khan, K. M. Physical inactivity remains the greatest public health problem of the 21st century: evidence, improved methods and solutions using the ‘7 investments that work’ as a framework. British Journal of Sports Medicine 48, 169–170 (2014).
95.Tudor-Locke, C., Craig, C. L., Thyfault, J. P. & Spence, J. C. A step-defined sedentary lifestyle index: <5000 steps/day. Applied Physiology, Nutrition, and Metabolism 38, 100–114 (2013).
96.Breen, L. et al. Two Weeks of Reduced Activity Decreases Leg Lean Mass and Induces ‘Anabolic Resistance’ of Myofibrillar Protein Synthesis in Healthy Elderly. The Journal of Clinical Endocrinology & Metabolism 98, 2604–2612 (2013).
97.Shephard, R. J. Sitting Time and Mortality from All Causes, Cardiovascular Disease, and Cancer. Yearbook of Sports Medicine 2010, 124–125 (2010).
98.Van der Ploeg, H. P. Sitting Time and All-Cause Mortality Risk in 222 497 Australian Adults. Archives of Internal Medicine 172, 494 (2012).
99.Dunstan, D. W. et al. Associations of TV viewing and physical activity with the metabolic syndrome in Australian adults. Diabetologia 48, 2254–2261 (2005).
100.Ekelund, U. et al. Dose-response associations between accelerometry measured physical activity and sedentary time and all cause mortality: systematic review and harmonised meta-analysis. BMJ l4570 (2019). doi:10.1136/bmj.l4570
101.Sonne, M. P. et al. Endothelial function after 10 days of bed rest in individuals at risk for type 2 diabetes and cardiovascular disease. Experimental Physiology 96, 1000–1009 (2011).
102.Sonne, M. P. et al. Effect of 10 days of bedrest on metabolic and vascular insulin action: a study in individuals at risk for type 2 diabetes. Journal of Applied Physiology 108, 830–837 (2010).
103.Arciero, P. J., Smith, D. L. & Calles-Escandon, J. Effects of short-term inactivity on glucose tolerance, energy expenditure, and blood flow in trained subjects. Journal of Applied Physiology 84, 1365–1373 (1998).
104.Alibegovic, A. C. et al. Impact of 9 Days of Bed Rest on Hepatic and Peripheral Insulin Action, Insulin Secretion, and Whole-Body Lipolysis in Healthy Young Male Offspring of Patients With Type 2 Diabetes. Diabetes 58, 2749–2756 (2009).
105.Bowden Davies, K. A. et al. Short-term decreased physical activity with increased sedentary behaviour causes metabolic derangements and altered body composition: effects in individuals with and without a first-degree relative with type 2 diabetes. Diabetologia 61, 1282–1294 (2018).
106.Stuart, C. A., Shangraw, R. E., Prince, M. J., Peters, E. J. & Wolfe, R. R. Bed-rest-induced insulin resistance occurs primarily in muscle. Metabolism 37, 802–806 (1988).
107.Mikines, K. J., Richter, E. A., Dela, F. & Galbo, H. Seven days of bed rest decrease insulin action on glucose uptake in leg and whole body. Journal of Applied Physiology 70, 1245–1254 (1991).
108.Crossland, H., Skirrow, S., Puthucheary, Z. A., Constantin‐Teodosiu, D. & Greenhaff, P. L. The impact of immobilisation and inflammation on the regulation of muscle mass and insulin resistance: different routes to similar end‐points. The Journal of Physiology 597, 1259–1270 (2018).
109.Knudsen, S. H. et al. Changes in insulin sensitivity precede changes in body composition during 14 days of step reduction combined with overfeeding in healthy young men. Journal of Applied Physiology 113, 7–15 (2012).
110.Slentz, C. A., Houmard, J. A. & Kraus, W. E. Modest Exercise Prevents the Progressive Disease Associated with Physical Inactivity. Exercise and Sport Sciences Reviews 18–23 (2007). doi:10.1249/01.jes.0000240019.07502.01
111.BASSETT, D. R. Limiting factors for maximum oxygen uptake and determinants of endurance performance. Medicine & Science in Sports & Exercise 70 (2000). doi:10.1097/00005768-200001000-00012
112.Myers, J. et al. Exercise capacity and mortality among men referred for exercise testing. ACC Current Journal Review 11, 33–34 (2002).
113.Response to exercise after bed rest and after training. American Heart Journal 78, 430 (1969).
114.Krogh-Madsen, R. et al. A 2-wk reduction of ambulatory activity attenuates peripheral insulin sensitivity. Journal of Applied Physiology 108, 1034–1040 (2010).
115.Ried-Larsen, M., Aarts, H. M. & Joyner, M. J. Effects of strict prolonged bed rest on cardiorespiratory fitness: systematic review and meta-analysis. Journal of Applied Physiology 123, 790–799 (2017).
116.Pišot, R. et al. Greater loss in muscle mass and function but smaller metabolic alterations in older compared with younger men following 2 wk of bed rest and recovery. Journal of Applied Physiology 120, 922–929 (2016).
117.Jiménez-Pavón, D., Carbonell-Baeza, A. & Lavie, C. J. Physical exercise as therapy to fight against the mental and physical consequences of COVID-19 quarantine: Special focus in older people. Progress in Cardiovascular Diseases (2020). doi:10.1016/j.pcad.2020.03.009
- et al. Preliminary Estimates of the Prevalence of Selected Underlying Health Conditions Among Patients with Coronavirus Disease 2019 — United States, February 12–March 28, 2020. MMWR. Morbidity and Mortality Weekly Report 69, 382–386 (2020).
119.Pinto, A. J., Dunstan, D. W., Owen, N., Bonfá, E. & Gualano, B. Combating physical inactivity during the COVID-19 pandemic. Nature Reviews Rheumatology (2020). doi:10.1038/s41584-020-0427-z
120.Lippi, G., Henry, B. M. & Sanchis-Gomar, F. Physical inactivity and cardiovascular disease at the time of coronavirus disease 2019 (COVID-19). European Journal of Preventive Cardiology 204748732091682 (2020). doi:10.1177/2047487320916823

